研究发现诺如病毒可在具有某些遗传变异的人中引发克罗恩病
克罗恩病是一种慢性炎症,一般在年轻的成年人中被诊断出来。克罗恩病的原因尚不清楚,但人们强烈怀疑它是由遗传、环境和微生物因素共同引发的。
超过30种不同的基因变体已经与克罗恩病风险的增加有关。然而,一个名为ATG16L1的基因中的一个特殊变体与该疾病特别相关。
该基因在肠道内的细胞中发挥着作用,但并不是每个有这种基因变异的人都会发展成克罗恩病。事实上,大约一半的美国人携带这种特定的突变,但只有一部分人被诊断出患有这种炎症性疾病。
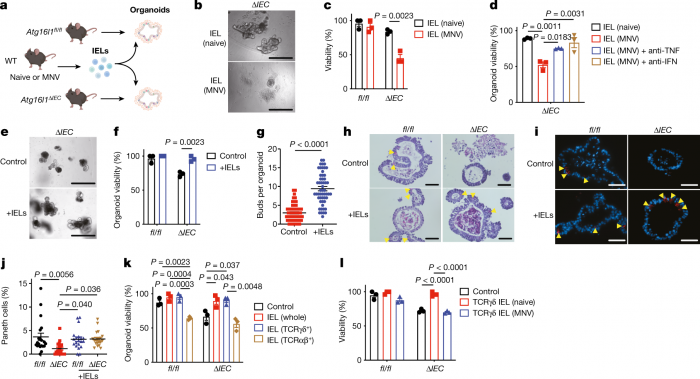
因此,这项新研究旨在了解在这种遗传易感性的同时,还有哪些其他因素可能促进肠道炎症。该研究重点关注一种被称为Paneth细胞的肠道细胞。这些细胞主要存在于小肠中,它们分泌抗菌分子。它们的作用是维持肠道中的微生物平衡,而那些有ATG16L1基因变体的人则表现出这些细胞的功能障碍。
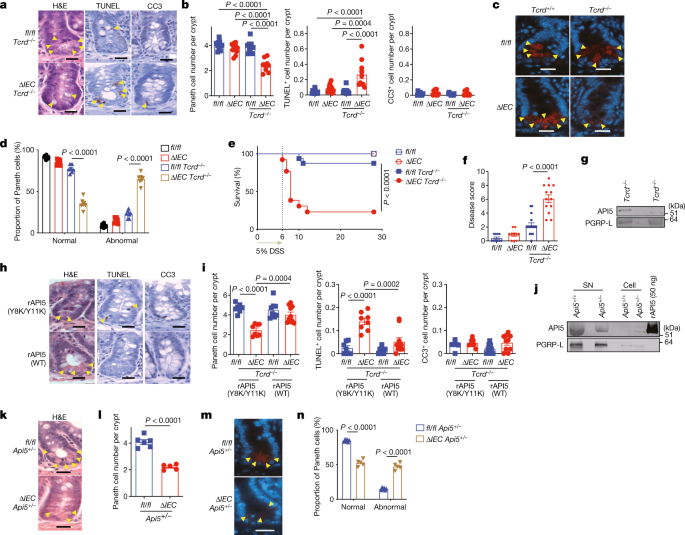
新研究的一个关键发现是,在具有ATG16L1变体的健康肠道中,免疫T细胞产生一种叫做细胞凋亡抑制因子5(API5)的蛋白质。这种蛋白质能确保免疫系统不攻击和杀死Paneth细胞。
但在用小鼠进行遗传工程以发展克罗恩病的实验中,研究人员发现诺如病毒的感染阻止了T细胞分泌API5,导致Paneth细胞死亡和克罗恩病的发生。而在另一个实验中,研究人员发现给克罗恩病小鼠注射API5后,与该疾病有关的存活率增加。
“我们的研究表明,当诺如病毒感染那些产生API5的能力减弱的人时,它使天平转向全面爆发的自身免疫性疾病,”该研究的共同高级作者Ken Caldwell解释说。
虽然该研究特别关注诺如病毒感染是导致API5破坏和Paneth细胞死亡的一个特定触发因素,但研究人员认为其他因素也可能开始这一系列事件。沙门氏菌已被发现可干扰API5的分泌,而吸烟是克罗恩病的一个已知风险因素,已与Paneth细胞缺陷有关。因此,在那些具有某些克罗恩病遗传易感性的人中,各种因素有可能触发这一过程。
这项新研究的主要作者Yu Matsuzawa-Ishimoto说:“我们的发现为API5在克罗恩病中发挥的关键作用提供了新的见解。这种分子可能为治疗这种慢性自身免疫性疾病提供一个新的目标,事实证明这种疾病很难长期控制。”
该研究仍有很长的路要走。API5的施用是否能成为人类患者的可行疗法,还有待探索。这一机制的发现确实为一种常见的炎症性肠病如何发展提供了新的启示,找到维持API5/Paneth细胞保护途径的方法可能是扭转一些患者疾病的方法。
这项新研究发表在《自然》杂志上。