是什么让人们有患阿尔茨海默病的风险?研究人员有了新的见解
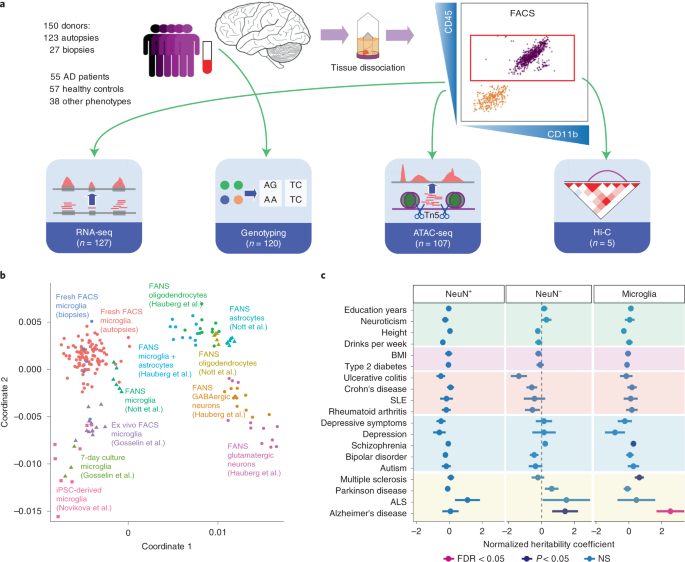
研究人员利用通过活检或尸检从150名捐赠者那里收集的新鲜人脑组织发现了21个前瞻性风险基因,他们强调其中一个,即SPI1,是小胶质细胞和AD风险的潜在关键调节器。
高级作者、西奈山伊坎医学院精神病学、遗传学和基因组学教授、疾病神经组学中心主任Panos Roussos博士说:“我们的研究是迄今为止最大的人类新鲜组织小胶质细胞分析,其遗传风险因素可能使某人易患阿尔茨海默病。通过更好地了解参与小胶质细胞功能的分子和遗传机制,我们就能更好地解开控制该功能并导致AD的调节图景。这种知识反过来又可以为目前没有有效治疗方法的疾病的新型治疗干预铺平道路。”
除了对神经元的发展和维护至关重要之外,小胶质细胞在大脑的免疫反应中发挥着重要作用。尽管先前的研究,包括一些来自西奈山的研究,已经表明小胶质细胞对阿尔茨海默病的遗传风险和进展很重要,但人们对这种情况背后的表观遗传机制了解甚少。
早期的研究大多采用动物或基于细胞系的模型,这些模型不能准确代表大脑中小胶质细胞活动的真正复杂性,因为小胶质细胞很难在人脑中分离出来。由于这些风险变量经常出现在基因组的非编码区(以前被称为"垃圾DNA"),分析起来更具挑战性,所以一直很难将AD的遗传风险变异与特定的分子功能联系起来。
西奈山团队的解决方案是通过四个大脑生物储存库之间的合作,从活检或尸检中获取新鲜的大脑组织,其中三个在西奈山,另一个来自拉什大学医学中心/拉什阿尔茨海默病中心。“使用来自这些来源的总共150个样本,我们能够分离出高质量的小胶质细胞,通过反映健康和神经退行性患者中小胶质细胞的整套调节成分,为遗传调节提供前所未有的见解,”Roussos博士解释说。
这一过程--比较来自AD和健康老年患者样本的表观遗传学、基因表达和遗传信息--使研究人员能够全面描述小胶质细胞的功能是如何在人类中受到遗传调节的。作为统计分析的一部分,他们扩大了先前全基因组关联研究的结果,将确定的AD易感基因变体与特定的DNA调控序列和基因联系起来,已知这些基因的失调直接导致了疾病的发展。他们进一步描述了全细胞调控机制,作为确定参与小胶质细胞活动特定方面的遗传区域的一种方式。
从他们的调查中出现了关于SPI1基因的新知识,该基因已经为科学家所熟知,是调节其他转录因子和基因网络的主要小胶质细胞转录因子,与AD有遗传关系。该团队正在生成的数据对于破译小胶质细胞发挥作用的其他神经退行性疾病背后的分子和遗传奥秘也很重要,包括帕金森病、多发性硬化症和肌萎缩性侧索硬化症。
Roussos博士承认,他的团队仍有许多工作要做,以充分了解已确定的基因如何有助于阿尔茨海默病的发展和进展,以及如何用新的治疗方法来针对它们。不过,他的实验室使用高度精密的仪器对小胶质细胞进行单细胞分析的结果令他大受鼓舞,这些分析正在揭示大脑及其周边地区不同类型的免疫细胞之间与神经退行性疾病有关的独特相互作用。“我们通过我们的单细胞数据看到了非常令人兴奋的结果,”Roussos博士报告说,“这使我们越来越接近于了解像阿尔茨海默病这样的遗传性疾病的基因驱动的变异和细胞特定的相互作用。”



